
Photo


SOMMAIRE
Les désordres affectant les structures en béton armé commencent à la surface du béton par de fines fissures et de légères traces de teinte ocre. Puis l’élargissement des fissures permet à la rouille (hydroxyde de fer) de suinter.
Des aciers presque totalement corrodés apparaissent après soulèvement et détachement des éclats de béton.
Elle peut être due à la composition du béton (mauvais rapport entre le sable et les gravillons par exemple, excès d’eau, …) ou bien à des insuffisances de vibration du béton au sein du coffrage.
Les conditions climatiques lors de la mise en œuvre du béton ont également une incidence certaine sur la porosité. Ainsi, par un temps sec et chaud, une dessiccation rapide du béton jeune, dont la surface n’a pas été protégée par un produit de cure approprié, peut être à l’origine d’une porosité excessive du matériau.
Un défaut de l’enrobage des armatures (distance entre acier et béton), par suite d’une erreur de lecture de plan de ferraillage ou bien d’une insuffisance de cales assurant le maintien des armatures à l’intérieur des coffrages peut entraîner ce type de désordre. Sous la pression du béton, la souplesse des cages d’armatures fait que celles-ci peuvent se coller contre le coffrage.
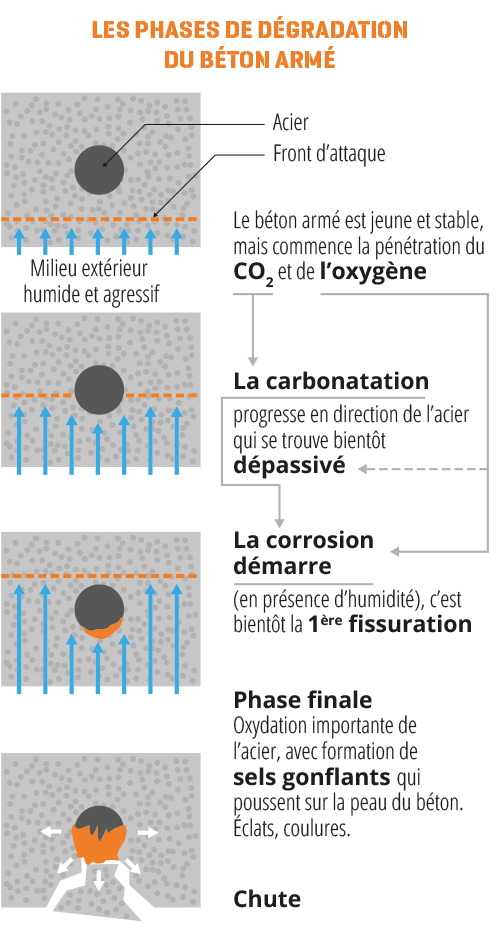
Les fissures structurelles des maçonneries (évoquées en fiche B1), sont des chemins préférentiels pour l’attaque des aciers par l’eau (1) et l’oxygène (entretenant le processus électrochimique engendrant la formation d’oxydes ferreux et ferriques expansifs*.
La pénétration potentielle d’ions chlorures contribue à la dépassivation du fer en modifiant la composition de la couche passive au niveau de l’armature par la formation concomitante de sels de fer.
(1) : Source Wikipedia
Quand le fer (ou l’acier) entre en contact avec l’eau, un processus électrochimique lent commence. Sur la surface du métal, du fer (état d’oxydation : 0) est oxydé pour passer à l’état d’oxydation II : Fe + 2OH- → Fe(OH)2 + 2e-, pendant que le dioxygène de l’air (degré d’oxydation 0) est réduit en ion hydroxyde : 2H2O + O2 + 4e- → 4OH-
Lors de la seconde étape (quasi instantanée) l’hydroxyde de fer II est rapidement oxydé en hydroxyde de fer III selon cette réaction : 4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3.
Finalement, cet hydroxyde de fer III se transforme spontanément en oxyde de fer III hydraté selon l’équation-bilan suivante : 2Fe(OH)3 → Fe2O3 + 3H2O.
* la carbonatation est un phénomène chimique initié par la diffusion du CO2 de l’air dans l’épaisseur du béton et contribuant fortement à la dépassivation des armatures, surtout en cas de porosité importante de la nature du béton.

Cette ressource est gratuite,
vous ne payerez que les frais de port
pour recevoir la version papier.
Cette ressource est payante, consultez sa page dédiée pour plus de détails.
Identifiant ou mot de passe invalide